今後行われる可能性のある治療法遺伝子治療
先天代謝異常症における治療の進歩
遺伝子治療の現状
大橋十也
東京慈恵会医科大学DNA医学研究所遺伝子治療研究部
同小児科
はじめに
1990年9月にadenosinedeaminase(ADA)欠損症を対象に米国で開始された遺伝子治療臨床研究は、当初対象となった単一遺伝子病ばかりでなく癌なども、対象として現在まで世界中で1300以上のプロトコールが承認されている。その内、症例数の多さを反映して癌を対象としたものが最も多い。しかしながら数多くの遺伝子治療臨床研究が行われているにもかかわらず、現在第3相試験まで至っている臨床試験は数%を占めるに過ぎず、現在承認されている遺伝子治療製剤に至っては2003年10月、中国のSiBiono社が開発したp53を発現するアデノウイルスベクター(商品名Gendicine)のみであり、これも世界的に受け入れられているとは言い難い。
単一遺伝子病に関しては、先天性免疫不全症の臨床試験の結果は非常に有望であったが白血病発症という重大な副作用が認められた。また血友病も遺伝子治療により治癒が期待できる疾患であるため積極的に臨床試験が行われている疾患であるが、最近の米国で行われたAAVベクターを用いた臨床研究では一過性に治療レベルの遺伝子発現が得られたのみであった。先天代謝異常症ではGaucher病、Ornithinetranscarbamylase(OTC)欠損症、Canavan病などで臨床試験が行われたが効果、副作用の面で大きな問題がありやはり実用化には至っていない。
以上の様に先天代謝異常症を含む単一遺伝性疾患の遺伝子治療では、まだ克服しなければならない問題点が多く残されている。しかしながら、ライソゾーム病を例にとると現行の酵素補充療法、骨髄移植療法は、生涯にわたり治療を継続しなければならないことや中枢神経障害に無効であること、ドナーが得られないことなどの欠点があり、それらを解決する可能性のある遺伝子治療法の開発に寄せる期待は大きい。本稿では先天性代謝異常症を含む単一遺伝子病を中心に、遺伝子治療臨床研究の現状を概説する。
世界における遺伝子治療の現状
Wiley社の統計によると1) 2007年7月現在、世界で1309の遺伝子治療の臨床研究が承認されている。国別ではアメリカが864プロトコールで全体の66%を占め、それに続き英国、ドイツ、スイス、フランス、ベルギーなどEU諸国が続く(表1)。日本はその時点で16プロトコール1.2%にすぎず、すぐれた基礎研究実績を持ちながら、それを臨床研究に持ってゆくシステムが非常に立ち遅れていることが浮き彫りされている。対象疾患であるが(表2)癌が871プロトコールと全体の66.5%を占める。本稿の主題である単一遺伝子病は109プロトコールで全体の8.3%を占めるにすぎない。単一遺伝子病の内訳を表3に占めす。Cysticfibrosisが最も多く、ADA欠損症、X-linkedseverecombinedimmunodeficiency(X-SCID)などの先天性免疫不全症を対象にしたプロトコールがそれに続く。先天代謝異常症ではmucopolysaccharidosisI型、II型、VII型、Gaucher病、Canavan病、OTC欠損症、Gyrateatrophy,Fabry病,Neuronalceroidlipofuscinosisなどのプロトコールが承認されているが実際に行われ論文などで発表になっているものはGaucher病、Canavan病、OTC欠損症だけである。
(図)年別遺伝子治療の臨床プロトコール数
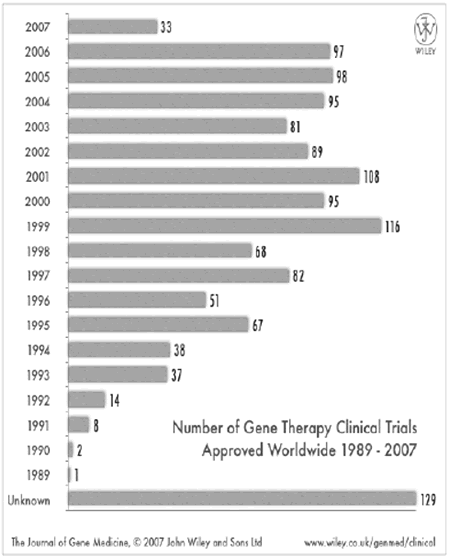 http://www.wiley.co.uk/genmed/clinical/
http://www.wiley.co.uk/genmed/clinical/
遺伝子治療で実際に第3相試験までいでいっているのは32プロトコールで全体の2.4%にすぎない(表4)。しかしながら1999年に100プロトコールを突破した臨床研究プロトコールはその後、副作用の出現などの問題が生じたにもかかわらず、年間100前後を推移しており現行の治療法の欠点を駆逐する可能性のある遺伝子治療に向ける臨床家、研究者の期待は大きいことを示すものである(図)。
本邦においても遺伝子治療臨床研究は欧米に後れはとっているものの確実に研究は継続されている。2008年1月23日現在での本邦の遺伝子治療臨床研究の状況を表5に示す2)。1995年に承認され実際に行われた北海道大のADA欠損症を対象に行われたのが本邦初の遺伝子治療である。その後主に癌を中心に様々な遺伝子治療臨床研究が行われ一定の成果を挙げており2008年1月現在、24プロトコールが承認されている。特にアンジェスMG社が行った閉塞性動脈硬化症、Buerger病を対象とした遺伝子治療は大阪大学の森下先生らのグループが開発した日本製の遺伝子治療であり第3相試験まで終了しており本邦初の遺伝子治療用製剤が承認される可能性が高いようである(私信)。この中で2,14、16は行われておらず、単一遺伝子病を対象に行われたのはADA欠損症のみであり、いわゆる先天代謝異常症を対象としたものはない。
主な単一遺伝子病の遺伝子治療
血友病の遺伝子治療
血友病は遺伝子治療により、治癒に近い効果が挙げられる可能性のある疾患として多くの研究者が研究を行っている。血友病Aの原因遺伝子である第VIII因子遺伝子は非常に大きいためウイルスベクターに搭載するのに問題があり、主に比較的遺伝子サイズの小さい第IX因子の欠損症である血友病Bの遺伝子治療の研究がおこなわれている。まずAAV2ベクターを用いた筋肉細胞を標的とした遺伝子治療臨床研究がAvigen社により行われた3)。対象症例は8例であった。結果は筋肉細胞に遺伝子は導入され、筋肉細胞での第XI因子の発現は認められた。しかし血中の第XI因子の濃度は最初の症例で若干認められたがその後の症例では認められなかった。これはベクター投与量が少ないのかまたはAAV2の筋肉への遺伝子導入効率が不足しているなどが考えられた。その後、やはりAvigen社により同じベクターを用いて肝臓を標的とした遺伝子治療臨床研究が行われた4)。対象症例は7例で投与量の異なる3つのグループに分けて行われた。最も投与量の多い群の症例で治療レベルの第XI因子の血中濃度が得られたが残念ながらGOT、GPTの上昇と伴に、第XI因子の血中濃度は低下した。これは発現した第XI因子に対してではなく、AAV2のCapsid蛋白に対する細胞障害性CD8陽性T細胞が誘導されたためであることが明らかになった。そしてこれらの細胞障害性CD8陽性T細胞はserotypeの異なるAAV8,AAV1のCapsid蛋白に対しても反応することが明らかとなった5)。これは一旦、ひとつのserotypeのCapsidに対し細胞障害性CD8陽性T細胞活性化されるとその他のserotypeのAAVのCapsid蛋白に対しても反応することが明らかとなった。これはAAVベクターのserotypeを変更しても遺伝子導入細胞は細胞障害性CD8陽性T細胞の攻撃の対象になることが明らかになった。以上の様な免疫反応は、マウスはもとより、イヌなどの大動物を用いての前臨床試験では全く認められなかった。
先天性免疫不全症の遺伝子治療臨床研究
先天性免疫不全症のなかで遺伝子治療臨床研究が積極的に行われているのはADA欠損症、X-SCIDそして慢性肉芽腫症(CGD)である。特にX-SCIDの臨床研究の結果は衝撃的であった(表6)。1999年にフランスのグループはレトロウイルスベクターを用いて造血幹細胞を標的として、本症の欠損遺伝子であるサイトカイン共通受容体γc鎖の遺伝子を導入し、患者さんに移植を行った6,7)。効果は極めて顕著で10例中9例の患者さんで遺伝子治療により成熟T細胞、NK細胞が出現し、8例の患者さんでT細胞数は正常域まで上昇した。また血中の抗体も増加した。すなわち10例中8例が著効という結果であった。他の造血幹細胞を標的とした遺伝子治療と比較し本症の遺伝子治療がうまくいったのは、本症には遺伝子導入細胞のみ選択的に増殖する所謂selectiveadvantageが認められるためである。本症の遺伝子治療の成功は遺伝子治療の効果があった初めての例であるだけに、関係者のなかで大きな反響をよんだ。しかし残念なことに、してほぼ同様のプロトコールで遺伝子治療が行わその後白血病発症という重大な副作用が発症した。れていたが8)、フランスの臨床研究と異なり、白現在までに4例の患者さんで、白血病は起き、その血病は発症せずフランスの臨床研究との相違、例内一人は死亡した。これはLMO2というプロトオえばウイルスを感染させる時の方法、使用したウンコジーンの近傍に治療用のベクターが挿入されイルスベクターのエンベロープの違いなどが議論LMO2遺伝子の発現が亢進した結果白血病が発症されていた。しかしながら最近になりやはりイギしたと考えられている。イギリスでもX-SCIDに対リスで遺伝子治療を行ったX-SCID10例中1例で白血病が発症した9)。やはりLMO2の異常発現が起こっておりフランスの場合と同様のメカニズムで白血病を発症したようであり基本的にレトロウイルスベクターを使用するときは遺伝子導入時の方法、ウイルスベクターのエンベロープの種類に関係なく、白血病は発症するということが判明した9)。以上の結果で現在フランス、イギリスの臨床研究とも終了し新たな患者さんへの遺伝子治療は行われていない。
ドイツにおける造血幹細胞を標的としたレトロウイルスベクターを用いたCGDの臨床研究も2例で当初かなり期待が出来る結果が報告された10)。CGDはX-SCIDなどと異なりselectiveadvantageが期待できないため、buslfanによる前処置の後に遺伝子治療は行われた。遺伝子治療後1例目は感染症症状も改善し良好な経過をであったが、500日目ぐらいより汎血球減少症が出現し歯科治療後の感染症がコントロールできずに死亡した。死亡時の骨髄細胞の80%はmonosomy7であったが、芽球の出現は認められず白血病とは言えない状態であった(前白血病状態)。2例目も当初は感染症もコントロールされ良好な経過だったが芽球が出現しmonosomy7が認められ、所謂骨髄異形成症候群の診断で骨髄移植を行う予定の様である。両者ともMDSプロトオンコジーンの近傍にベクターの挿入が認められMDS遺伝子の発現増強が認められた。もう1例はスイスで行われた症例だが経過は良好だが遺伝子導入細胞は認められていない。
以上のように造血幹細胞を標的とした遺伝子治療では挿入変異という問題を解決しなければ今後安全に治療を行うことはできない。造血幹細胞を標的としたレトロウイルスベクター(レンチウイルスベクターも含む)を用いた遺伝子治療法は先天代謝異常症特に、ライソゾーム病やadrenoleukodystrophy症などでも同様のプロトコールが使用されるので先天代謝異常症の遺伝子治療法を行う上でも非常に重要な課題である。
先天代謝異常症の遺伝子治療
先天代謝異常症の遺伝子治療は先にも述べたが実際に行われ論文などで発表になっているものはGaucher病、Canavan病、OTC欠損症だけである。Gaucher病の遺伝子治療はやはり造血幹細胞を標的にレトロウイルスベクターを用いて行われ、その結果は1998年に発表された11)。3例を対象に行われたが結果は1例で末梢血中に導入遺伝子が認められたがそれも3か月までで6か月以降は認められなかった。遺伝子導入細胞の頻度も非常に低く0.02%程度であり、臨床効果も認められなかった。ヒト造血幹細胞への遺伝子導入の困難さを物語る結果となった。ただこの臨床研究ではselective advantageが期待できない疾患であるのにbuslfanなどの前処置は行われなかった。Canavan病に関しては欠損酵素の遺伝子を発現するAAVベクターを直接脳内に投与する治療が行われたが治療効果に関する論文は発表されておらず詳細は不明である。1997年4月より米国ペンシルバニア大学で行われたOTC欠損症の遺伝子治療臨床研究は非常に問題のある臨床研究であり、結果的に死亡者をだすという最悪の結果となった12)。欠損遺伝子を発現するアデノウイルスベクターを経肝動脈的に肝臓に投与するというものであったが、最高量のウイルスベクターを投与した患者さんが劇症肝炎からDICを併発し死亡した。米国のFDAはこのトライアルに対して多くの問題点を指摘した。それらは(1)遺伝子治療ベクター作成に必須とされる標準業務手順書を作成していなかった(2)サルを用いた実験で2匹の死亡例を報告していなかったこと(3)被験者死亡者により低いベクターを投与した患者に発症した重篤な肝障害例を報告していなかったこと(4)患者選択の際にプロトコールに従った選考がなされていなかったこと(5)被験者に対して、この遺伝子治療の効果を偽って説明したこと、などである。特にコントロール良好な症例に、一過性の発現しか期待できず、繰り返し投与もできないアデノウイルスベクターを使用して臨床研究を行ったことは大きな問題であった。
先天代謝異常症を含む単一遺伝子病の遺伝子治療の今後の課題
単一遺伝子病の遺伝子治療で克服しなければならない大きな問題は血友病の臨床研究で問題となったウイルスベクターの蛋白質そして遺伝子産物に対するホストの免疫反応、X-SCID、CGDのトライアルで問題となった挿入変異、そしてGaucher病の遺伝子治療のトライアルで問題となったヒト造血幹細胞への遺伝子導入効率の低さである。以上の問題点は先天代謝異常症の遺伝子治療においても全く当てはまる問題である。これらを克服する目的で様々な試みがなされている。免疫反応の問題では組織特異的プロモーターを用いると免疫寛容が誘導されることが報告されている。また挿入変異に関しては(1)Self-inactivated vectorを用いる、(2)発現単位が周囲の遺伝子と隔絶されるようにinsulatorを用いる、(3)発癌した際にその細胞を死滅させるべく自殺遺伝子を搭載するなどの試みがなされている。また究極の遺伝子治療である遺伝子を治療する遺伝子治療の開発も進んでいる。造血幹細胞への遺伝子導入効率の低さの克服は今まで用いていたオンコレトロウイルスではなくヒトにAIDSを発症させるレンチウイルスベクターなどが試みられている。
以上の様にベクターを改善しadrenoleukodystrophy 症、mucopolysaccharidosis VII型、Neuronal ceroid lipofuscinosis、Metachromatic leukodystrophy 症などの遺伝子治療が計画されている。
最後に
以上、先天代謝異常症を含む単一遺伝子病への遺伝子治療の現状を概説した。遺伝子治療はまだ発展段階の治療であるが、試行錯誤の上、問題点も明らかにされ、またそれを克服する方法も焦点が定まってきたと言える。ライソゾーム病の酵素補充療法も、実際にヒトに対して使用されるまでには20年以上の月日を要した。これには分子生物学の発展に負うところが大きい。世界初の遺伝子治療が行われたのが1990年であったのを考えると、遺伝子治療が先天代謝異常症の治療のオプションとして臨床の場に登場するのも、もう数年かかると考える。現行の治療法、例えばライソゾーム病の酵素補充療法にしても完璧な治療とは言えないのは本誌の読者の一致した考えではないだろうか?それだけに遺伝子治療の開発に期待をする読者は多いと思う。
本稿が多くの読者に遺伝子治療の将来性について考えてもれえるようになれば幸いである。
文献
- http://www.wiley.co.uk/genmed/clinical/
- http://www.nihs.go.jp/cgtp/cgtp/sec1/gt_prtcl/prtcl-j3.html
- Manno CS, Chew AJ, Hutchison S, Larson PJ, Herzog RW, Arruda VR, Tai SJ, Ragni MV, Thompson A, Ozelo M, Couto LB, Leonard DG, Johnson FA, McClelland A, Scallan C, Skarsgard E, Flake AW, Kay MA, High KA, Glader B:AAVmediated factor IX gene transfer to skeletal muscle in patients with severe hemophilia B. Blood. 101:2963-72, 2003.
- Manno CS, Pierce GF, Arruda VR, Glader B, Ragni M, Rasko JJ, Ozelo MC,ots K, Blatt P, Konkle B, Dake M, Kaye R, Razavi M, Zajko A, Zehnder J, Rustagi PK, Nakai H, Chew A, Leonard D, Wright JF, Lessard RR, Sommer JM, Tigges M, Sabatino D, Luk A, Jiang H, Mingozzi F, Couto L, Ertl HC, High KA, Kay MA. Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response. Nat Med. 12:342-7, 2006.
- Mingozzi F, Maus MV, Hui DJ, Sabatino DE, Murphy SL, Rasko JE, Ragni MV, Manno CS, Sommer J, Jiang H, Pierce GF, Ertl HC, High KA.CD8(+)T-cell responses to adeno-associated virus capsid in humans. Nat Med. 13:419-22, 2007.
- Cavazzana-Calvo M, Hacein-Bey S, de Saint Basile G, Gross F, Yvon E, Nusbaum P, Selz F, Hue C, Certain S, Casanova JL, Bousso P, Deist FL, Fischer A. Gene therapy of human severecombined immunodeficiency (SCID)-X1 disease. Science. 288(5466):669-72, 2000.
- Hacein-Bey-Abina S, Le Deist F, Carlier F, Bouneaud C, Hue C, De Villartay JP, Thrasher AJ, Wulffraat N, Sorensen R, Dupuis-Girod S, Fischer A, Davies EG, Kuis W, Leiva L, Cavazzana-Calvo M. Sustained correction of X-linked severe combined immunodeficiency by ex vivo gene therapy. N Engl J Med. 346:1185-93, 2002.
- Gaspar HB, Parsley KL, Howe S, King D, Gilmour KC, Sinclair J, Brouns G, Schmidt M, Von Kalle C, Barington T, Jakobsen MA, Christensen HO, Al Ghonaium A, White HN, Smith JL, Levin-sky RJ, Ali RR, Kinnon C, Thrasher AJ. Gene therapy of X-linked severe combined immunodeficiency by use of a pseudotyped gammaretroviral vector. Lancet. 364:2181-7, 2004.
- http://www.esgct.org/upload/X-SCID_statement_AT.pdf
- Ott MG, Schmidt M, Schwarzwaelder K, Stein S, Siler U, Koehl U, Glimm H, Kuhlcke K, Schilz A, Kunkel H, Naundorf S, Brinkmann A, Deichmann A, Fischer M, Ball C, Pilz I, Dunbar C, Du Y, Jenkins NA, Copeland NG, Luthi U, Hassan M, Thrasher AJ, Hoelzer D, von Kalle C, Seger R, Grez M. Correction of X-linked chronic granulomatous disease by gene therapy, augmented by insertional activation of MDS1-EVI1, PRDM16 or SETBP1. Nat Med. 2006 12:401-9, 2006.
- Dunbar CE, Kohn DB, Schiffmann R, Barton NW, Nolta JA, Esplin JA, Pensiero M, Long Z, Lockey C, Emmons RV, Csik S, Leitman S, Krebs CB, Carter C, Brady RO, Karlsson S.Retroviral transfer of the glucocerebrosidase gene into CD34+ cells from patients with Gaucher disease: in vivo detection of transduced cells without myeloablation. Hum Gene Ther. 9:2629-40, 1998.
- Raper SE, Chirmule N, Lee FS, Wivel NA, Bagg A, Gao GP, Wilson JM, Batshaw ML. Fatal systemic inflammatory response syndrome in a ornithine transcarbamylase deficient patient following adenoviral gene transfer. Mol Genet Metab. 80:148-58, 2003.
