ライソゾーム病に関して(各論)医師向けガラクトシアリドーシス
疾患番号 18
1.概要、欠損酵素
本症の原因は、ライソゾーム性保護蛋白質/カテプシンA(PPCA)の活性低下にある。PPCAは、それ自体がカテプシンA(酸性カルボキシペプチダーゼ、中性セリンエステラーゼおよびデアミダーゼ)としての酵素活性を持つだけでなく、細胞内においてはライソゾーム性シアリダーゼやβ-ガラクトシダーゼと共に高分子複合体を形成して、前者を活性化し、後者を安定化する機能を持つ多機能性糖蛋白質である。このPPCAの遺伝的異常により、一次的なカテプシンA活性の低下と二次的なライソゾーム性シアリダーゼおよびβ-ガラクトシダーゼ活性の低下が起こり、その結果、シアリドーシス(ライソゾーム性シアリダーゼ欠損症)類似の臨床症状を来たす疾患がガラクトシアリドーシスである。
2.病態
本症では、PPCAの異常により、ライソゾーム性シアリダーゼの活性化が起こらず、当該酵素活性が著明に低下する。このため、シアリドーシスの場合と同様に、非還元末端にシアル酸残基を持つオリゴ糖や糖蛋白質および糖脂質が分解されずに細胞内に蓄積して、細胞が障害を受けると考えられる。このため、ガラクトシアリドーシスの臨床症状は、シアリドーシスのそれに極めてよく似ている。一方、本症におけるβ-ガラクトシダーゼ活性の低下は、GM1ガングリオシドーシスやモルキオB病(いずれも、β-ガラクトシダーゼ遺伝子の異常により、当該酵素活性が一次的に著明に低下する疾患)の場合と異なり、中等度にとどまり、正常対称の10~30%程度の残存活性を生じる。このため、本症におけるβ-ガラクトシダーゼの活性低下は、その病態発現に対して、少なくとも大きな影響を与えていないと考えられる。
PPCAは、それ自体がカテプシンAとしての酵素機能を持っており、in vitroでエンドセリン1やタキキニンなどの生理活性物質のカルボキシ末端のアミノ酸残基を分解して修飾する働きがある。本症では、患者由来の各臓器の可溶性画分でのエンドセリン1分解活性の低下がみられ、脳組織でのエンドセリン1様免疫交叉物質の蓄積が認められる。従って、それらの生理活性物質の代謝異常が、本症の臨床像の形成に何らかの影響を与えている可能性がある。シアリドーシスおよびガラクトシアリドーシスのノックアウトマウスの比較によれば、後者ではPurkinje細胞の早期変性が著しい点に違いがあるとの報告がある。ガラクトシアリドーシス患者の病理学的分析の結果では、小脳や視床などで神経細胞数の減少とグリオーシスがみられている。また、培養線維芽細胞の電顕所見として、空胞状および層状の封入体の存在が報告されている。
3.遺伝形式
常染色体劣性遺伝形式をとる。保護蛋白質/カテプシンAをコードする遺伝子の座は、第20番染色体の長腕(20q13.1)に局在する。本症の病因遺伝子変異として、Q49R, S51Y, W65R, G85S, S90L, V132M, L236P, Y249N, Y395C, M406T, G439S, F440V, K453E, IVS7-3(a→g) などが同定されている(アミノ酸番号に関しては、報告により異なる場合があるため、ここでは翻訳開始コドンとなるメチオニンを1番とする表記に統一した)。
4.分類
発症年齢により、早期乳児型、晩期乳児型および若年/成人型に分類される。
5.人種差、発症頻度
早期乳児型は、日本人や白人の患者が報告されている。晩期乳児型は、アラブ人などで症例が報告されている。若年/成人型の症例のほとんどは日本人である。全体で、80以上の症例が報告されているが、正確な発症頻度については算定されていない。
6.症状
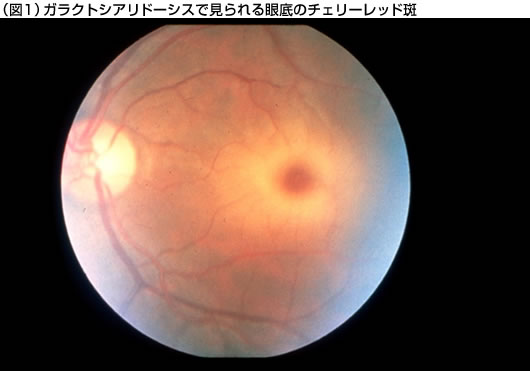
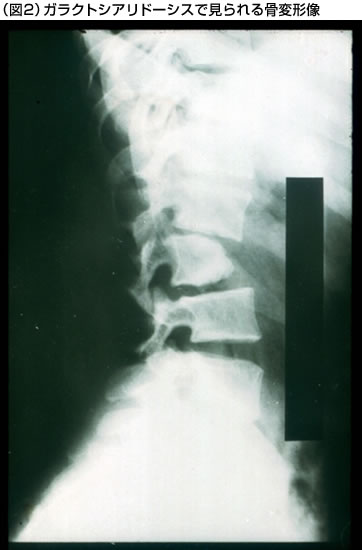
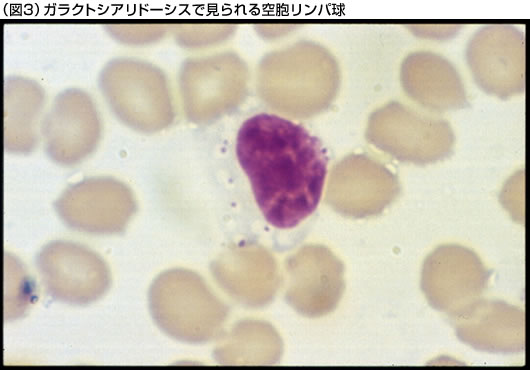
早期乳児型では、出生時から浮腫や腹水がみられる。粗な顔貌、骨の変形、肝臓や脾臓の腫大、鼠径ヘルニア、臍ヘルニア、心不全、腎不全、呼吸障害や中枢神経障害などの臨床症状を伴い、急速に進行して重症の臨床経過をとる。晩期乳児型では、生後数ヵ月から1~2歳頃に、肝臓や脾臓の腫大や骨変形などの症状で発症するが、その後は比較的緩やかな経過をとる症例が多い。神経症状については、その程度が軽いか、または全く見られない症例が多い。また、この型では、心臓弁膜障害を伴う症例も報告されている。若年/成人型では、5歳以後、多くは10歳以後に視力障害などの症状で発症し、小脳性失調、ミオクローヌス、痙攣発作、錐体路障害、眼底のチェリーレット斑(図1)、角膜混濁、粗な顔貌、骨の変形(図2)、被角血管腫、リンパ球の空胞化(図3)、腎障害、心障害などの多彩な臨床症状が出現する。
7.診断
上記の臨床症状や所見から本症が疑われれば、生化学的解析を行う。臨床試料を用いて、カテプシンAおよびライソゾーム性シアリダーゼの著明な活性低下とβ-ガラクトシダーゼの中等度の活性低下を証明する。試料としては、皮膚や骨髄に由来する培養線維芽細胞が適している。尿中の結合型シアリルオリゴ糖の排泄増加がみられれば、参考になる。
8.治療
残念ながら、本症に対する確実な根本的治療法は確立されていない。生活の質の向上を目指した対症療法が中心となる。ミオクローヌスや痙攣発作に対して、クロナゼパムが有効とされている。骨髄移植の有効性に関しては、まだ施行された症例数の少なく、今後、長期予後を詳細に評価する必要がある。実験的には、マウスの血球前駆細胞にヒトPPCAcDNAを導入して高発現させ、これを、ガラクトシアリドーシスのモデルマウスに投与したところ、病理学的改善がみられたという報告がある。
